Denunció que el supuesto sedante inocuo para la salud de las parturientas provocaría efectos deformantes en los niños. Era teratógeno, un fármaco que causa malformaciones congénitas. Los médicos y laboratorios la atacaron y descalificaron diciendo que era una “pequeña burócrata” y que su investigación “carecía de una base sólida y científica”.
| Image may be NSFW. Clik here to view.  |
| La farmacóloga Frances Oldham Kelsey, fue una verdadera heroína que salvó a miles de niños de tener malformaciones. |
La canadiense no se dejó acobardar, siendo presionada en seis oportunidades en el lapso de 14 meses, para que apruebe el medicamento pero no se rindió y gracias a eso salvó a miles de niños al impedir que la talidomida, llegara a las embarazadas norteamericanas. El sedante se vendía en Europa con el rótulo: "Especialmente conveniente para el embarazo". El fármaco fue responsable de la muerte o deformación de más de 15.000 niños en Europa, Oriente Próximo y Australia, y por poco estuvo a punto de provocar un desastre en suelo estadounidense si la doctora Kelsey no se hubiera opuesto.
La farmacóloga canadiense Frances Oldham Kelsey, responsable de impedir la entrada en el mercado estadounidense de la horrorosa talidomida falleció en London, Ontario, a los 101 años de edad el pasado viernes 7 de agosto de 2015.
| Image may be NSFW. Clik here to view.  |
| Logo de la Administración de Medicamentos y Alimentos de los Estados Unidos. |
A pesar de las quejas de la empresa farmacéutica, que tachó a Kelsey de "pequeña burócrata", según el obituario del New York Times, la doctora insistió en sus peticiones y, ante la falta de respuestas, inició una investigación particular que la llevó, en febrero de 1961, a citar un artículo del British Medical Journal donde se denunciaba que la talidomida podría causar ciertos daños en los recién nacidos.
| Image may be NSFW. Clik here to view.  |
| La doctora Kelsey no cedió a las amenazas de la mafia farmacéutica y la venta de la talidomida no se aprobó en los Estados Unidos. |
| Image may be NSFW. Clik here to view.  |
| Contergan Forte, la talidomida se vendía con este nombre comercial en Alemania. |
La compañía Merrell había declarado que los anuncios de la doctora Kelsey carecían de base. "Tenía la sensación", declaró Kelsey a posteriori, "de que no habían sido sinceros conmigo". Finalmente, la aplastante evidencia recogida en Europa y Oriente Próximo sobre los efectos de la talidomida logró impedir el envío masivo del medicamento a todas las embarazadas de Estados Unidos.
| Image may be NSFW. Clik here to view.  |
| En España la talidomida se bautizó como Softenón y afectó a más de 3000 niños. |
| Image may be NSFW. Clik here to view.  |
| El Kevadon hubiera provocado la muerte de miles de niños norteamericanos y teratogenia en muchos más. |
| Image may be NSFW. Clik here to view.  |
| En Suecia la talidomida se vendía con el nombre de fantasía de Neurosedyn. |
| Image may be NSFW. Clik here to view.  |
| La doctora Kelsey explicando porque no autorizó la venta de la talidomida en los Estados Unidos. |
| Image may be NSFW. Clik here to view.  |
| Frances Kelsey en su oficina de la FDA. |
| Image may be NSFW. Clik here to view.  |
| Niños con teratogenia a causa de la talidomida. |
| Image may be NSFW. Clik here to view.  |
| La doctora Kelsey con el presidente John F. Kennedy en 1962, el momento en que le otorga la Medalla al Mérito Civil, el máximo galardón honorífico concedido por el gobierno estadounidense a un ciudadano. |
En 1963 le dieron el galardón de la Llave de Oro de la Universidad de Chicago. Durante el transcurso de su carrera también participó en la aprobación y aplicación de leyes para reforzar la supervisión y control de la FDA sobre los productos farmacéuticos.
Su trabajo en la FDA y la talidomida
En 1960, fue contratada por la FDA en Washington, D.C. En ese momento, «era uno de los siete únicos médicos a tiempo completo y cuatro a tiempo parcial, encargados de la revisión de medicamentos». Una de sus primeras tareas en la FDA fue revisar la solicitud presentada por Richardson Merrell para lanzar al mercado estadounidense la talidomida (bajo el nombre comercial de Kevadon), como tranquilizante y calmante, con la indicación específica de prescribir el medicamento a las mujeres embarazadas en caso de malestares matutinos. A pesar de que había sido aprobado en más de veinte países europeos y africanos, se negó a autorizar el medicamento y exigió más estudios; y pese a la presión del fabricante por obtener la aprobación, la doctora insistió en solicitar información adicional.
| Image may be NSFW. Clik here to view.  |
| Los directivos de la compañía William S. Merrell que estuvieron durante 14 meses presionando a la doctora Kelsey para que autorice la talidomida. Hoy se ha reciclado como Dow Chemical Inc. |
La insistencia de la doctora en que el medicamento debía ser completamente analizado antes de su aprobación resultó dramáticamente justificada, cuando el nacimiento de niños deformes en Europa fue vinculado a la ingestión de talidomida por sus madres durante el embarazo.
| Image may be NSFW. Clik here to view.  |
| El médico alemán Widukind Lenz alertó que la talidomida era la causa de las malformaciones en los recién nacidos. El 29 de noviembre de 1961 se interrumpió la venta del sedante Contergan en Alemania. |
Meses más tarde se comprobó que hubomás de 15.000 niños afectados en 46 países.Los principales países con víctimas de la talidomida en América Latina fueron Brasil (Ectiluran, Ondasil, Sedalis, Sedin) y Argentina, donde se vendía con el nombre de Softenil. Las autoridades prohibieron su elaboración, venta y consumo.
| Image may be NSFW. Clik here to view.  |
| La talidomida se vendía como "especialmente conveniente para el embarazo". |
| Image may be NSFW. Clik here to view.  |
| La doctora Kelsey recibe el máximo galardón de la nación de manos del presidente Kennedy en 1962. |
Después de recibir el premio Kelsey continuó su trabajo en la FDA. Desde allí desempeñó un papel clave en la elaboración y aplicación de las enmiendas de 1962. También se convirtió en responsable de dirigir la vigilancia de las pruebas de medicamentos en la FDA. Finalmente se jubiló en 2005, a los noventa años de edad, después de 45 años de servicio.
Últimos años y muerte
En 1994 una escuela secundaria de la Columbia Británica fue nombrada en su honor. En el año 2000 pasó a estar inscripta en el National Women's Hall of Fame (Salón Nacional de la Fama femenino, una institución estadounidense cuya misión es «honrar a perpetuidad a las mujeres ciudadanas de los Estados Unidos de América cuyas contribuciones a las artes, deportes, negocios, educación, gobierno, humanidades, filantropía y ciencias, han sido de gran valor para el desarrollo de su país».
| Image may be NSFW. Clik here to view. |
| Frances O. Kelsey en 2005. |
| Image may be NSFW. Clik here to view.  |
| Kelsey en el año 2010. |
Kelsey falleció el 7 de agosto de 2015 en London, Ontario, a la edad de 101 años, menos de 24 horas después de que la teniente gobernadora de Ontario, Elizabeth Dowdeswell, la visitó para entregarle la insignia de miembro de la Orden de Canadá por su labor para bloquear la talidomida.
Vuelve la talidomida
A pesar del grave daño que ha provocado este fármaco, en la actualidad, la talidomida se vuelve a utilizar, con el apoyo de la OMS, en algunos países, calificados como “bananeros” y también en otros más avanzados porque según Jacob Sheskin, un dermatólogo judío, es supuestamente “buena para combatir la lepra”. Dice que en 1965 descubrió que cuando quiso utilizar la talidomida como sedante en cuatro pacientes que sufrían eritema nodoso lepromatoso (ENL), una complicación inflamatoria aguda de lepra lepromatosa. Entonces, para su sorpresa, vio como las lesiones mejoraban en pocas horas. Con ello, la talidomida retomó el interés científico como una droga inmunomoduladora.
| Image may be NSFW. Clik here to view.  |
| Niño brasileño sin brazos ni piernas afectado por la talidomida, descubierto en 1997. |
Pero seguirá haciendo estragos si no se la prohíbe de nuevo porque ya se conocen casos de nacimientos de niños con dismelia en Etiopía en padres tratados con talidomida y el matutino austriaco Der Standard reportó el 7 de marzo de 1996 "que hay bebés malformados por la talidomida en la India. Y según informaciones confiables, que recuerdan los casos suecos de la talidomida –prosigue el mismo medio—, un estudiante de medicina británico dijo haber visto a un cierto número de niños afectados por la talidomide en la ciudad de Pucallpa (una ciudad peruana conocida por sus numerosos casos de lepra). En varias localidades brasileñas entre los años 1996 y 1997 nacieron niños sin brazos ni piernas, sus padres habían sido tratados con la talidomida para combatir la lepra. Esto lo denunció James Cutler, el productor del documental de Yorkshire TV, de la televisión británica "La droga que volvió". En el mismo, aparecen niños sin piernas o sin brazos, nacidos en áreas rurales de Brasil. Denunció que la talidomida se vende en 47 países donde están naciendo nuevos casos de bebés afectados por la talidomida.
| Image may be NSFW. Clik here to view. 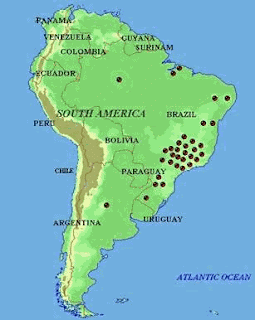 |
| Casos de niños con malformaciones provocadas por la talidomida entre 1969 y 1995 a pesar que estaba prohibida en esos años. |
También se están realizando ensayos con talidomida y algunos de sus derivados en enfermos que padecen ciertos tipos de cáncer. Aparentemente se ha comprobado su eficacia en casos de mieloma múltiple, aplicándose especialmente en casos en los que los tratamientos convencionales (quimio y radioterapia) no han tenido éxito o no son viables.
Más información sobre afectados por la talidomida la encontrará aquí:
Más información sobre afectados por la talidomida la encontrará aquí: